خلال جائحة كوفيد، أنفقت حكومة الولايات المتحدة مليارات الدولارات على ما يقرب من 400 منتج يهدف إلى حماية وتشخيص وعلاج مئات الملايين من الناس - كل ذلك تحت علامة "EUA" أو "ترخيص الاستخدام في حالات الطوارئ".
ولكن ماذا تعني EUA في الواقع؟
حتى قبل أن نجيب على هذا السؤال، ومن خلال فهم موقف ترخيص الاستخدام النهائي فيما يتعلق بالمسارات الأخرى لترخيص المنتجات الطبية أو الموافقة عليها، من المفيد النظر إلى ما ليس EUA:
ترخيص الاستخدام النهائي (EUA) ليس تسمية لمنتج تجريبي يخضع لتجربة سريرية
إذا كنا نفهم شيئًا واحدًا فقط عن ترخيص الاستخدام النهائي (EUA)، فيجب أن يكون هذا: لا تنطبق اتفاقية ترخيص المستخدم النهائي (EUA) على منتج يخضع لتجربة سريرية تحكمها لوائح إدارة الغذاء والدواء (FDA) أو المتطلبات القانونية الأخرى.
كما أن ترخيص الاستخدام النهائي يختلف أيضًا عن استخدام الوصول الموسع (EAU)، والذي يُطلق عليه غالبًا الوصول إلى "الاستخدام الرحيم"، والذي ينطبق على منح المرضى الذين يعانون من أمراض خطيرة وغير قابلة للشفاء إمكانية الوصول إلى المنتجات التجريبية قبل الموافقة عليها بشكل كامل.
هذا الجدول من عرض FDA-CDC 2020 يلخص الاختلافات بين المنتجات التي تخضع للتجارب السريرية، والمنتجات المقدمة للمرضى من خلال الوصول "الرحيم" الموسع، والمنتجات المصرح بها من خلال ترخيص الاستخدام النهائي:
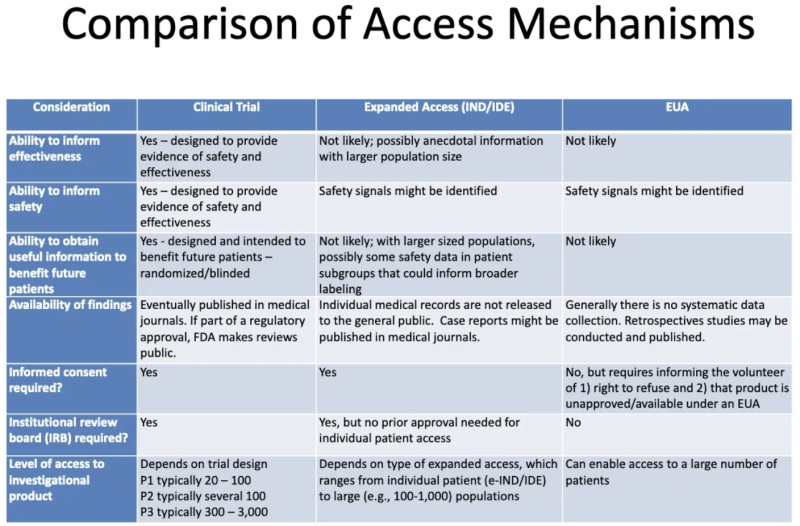
إليك ما يخبرنا به هذا الجدول حول EUA:
- من غير المرجح أن تؤدي عملية منح ترخيص الاستخدام النهائي (EUA) إلى توليد أي معلومات حول فعالية المنتج.
- لم يتم تصميم عملية منح ترخيص الاستخدام النهائي لتوفير دليل على السلامة أو الفعالية، ولكن يمكن تحديد إشارات السلامة.
- من غير المحتمل، بمجرد منح المنتج ترخيص الاستخدام النهائي (EUA) وإدارته لبعض المرضى، أنه سيتم الحصول على أي معلومات مفيدة لصالح أي مريض في المستقبل.
- لا يوجد جمع منهجي للبيانات حول الفعالية أو السلامة باستخدام EUA، ولا يتم نشر أي بيانات في المجلات الطبية كجزء من عملية الموافقة التنظيمية.
- ليست هناك حاجة إلى موافقة مستنيرة، ولكن يجب إخبار المرضى الذين "يتطوعون" لتناول المنتج بأنه يمكنهم الرفض وأن المنتج غير معتمد/متاح بموجب ترخيص الاستخدام النهائي (EUA).
- ليس هناك حاجة إلى مجلس المراجعة المؤسسية (IRB). [IRB هي لوحة من المفترض أن تحمي صحة البشر في التجارب السريرية]
لمزيد من التوضيح حول كيفية فصل ترخيص الاستخدام النهائي عن أي عملية موافقة عادية، في أ 2009 معهد الطب منشورات الأكاديميات الوطنية، نجد هذا البيان:
من المهم أن ندرك أن اتفاقية الاستخدام النهائي ليست جزءًا من مسار التنمية؛ وهو كيان منفصل تمامًا يُستخدم فقط في حالات الطوارئ ولا يشكل جزءًا من عملية الموافقة على الأدوية. (ص28)
كي تختصر:
من غير المرجح أن تؤدي عملية منح ترخيص الاستخدام النهائي لمنتج ما إلى أي دليل على السلامة أو الفعالية. بمجرد منح المنتج ترخيص الاستخدام النهائي وإدارته للمرضى، فمن غير المرجح أن يتم الحصول على أي معلومات مفيدة لصالح المرضى في المستقبل، لأنه لا يوجد جمع منهجي للبيانات حول الفعالية أو السلامة.
بناءً على كل هذه المعلومات الواضحة للغاية من مراكز مكافحة الأمراض والوقاية منها/إدارة الغذاء والدواء الأمريكية ووكالة IMNA، سيكون من العدل أن نستنتج أن ترخيص الاستخدام في حالات الطوارئ هو عملية يجب تطبيقها بحكمة شديدة وفقط في حالات الطوارئ الشديدة.
الآن دعونا نلقي نظرة على أنواع حالات الطوارئ التي تم تصميم EUA قانونًا لمعالجتها.
EAU مخصص لحالات الطوارئ الخاصة بأسلحة الدمار الشامل
تم وضع القوانين التي تسمح بـ "آلية الوصول" الموصوفة أعلاه لاتفاقية ترخيص المستخدم النهائي لحالات الطوارئ القصوى والفورية التي تنطوي على أسلحة الدمار الشامل، والتي يشار إليها أيضًا باسم العوامل الكيميائية والبيولوجية والإشعاعية والنووية.
وإليك كيف إدارة الغذاء والدواء (FDA) تصف صلاحياتها في اتفاقية ترخيص المستخدم النهائي (EUA).:
القسم 564 من قانون FD&C (21 جامعة جنوب كاليفورنيا 360 ب ب – 3) يسمح لإدارة الغذاء والدواء بتعزيز حماية الصحة العامة ضد العوامل البيولوجية والكيميائية والنووية والإشعاعية.
من خلال سلطة ترخيص المستخدم النهائي هذه، يمكن لإدارة الغذاء والدواء الأمريكية المساعدة في ضمان إمكانية استخدام التدابير الطبية المضادة في حالات الطوارئ لتشخيص أو علاج أو الوقاية من الأمراض أو الحالات الخطيرة أو التي تهدد الحياة والتي تسببها عوامل بيولوجية أو كيميائية أو نووية أو إشعاعية عندما لا يكون هناك ما يكفي منها ومعتمد. والبدائل المتاحة (من بين معايير أخرى).
تم منح صلاحيات ترخيص الاستخدام النهائي هذه في عام 2004 في ظل ظروف محددة للغاية تتعلق بالاستعداد للهجمات التي يشنها عملاء المواد الكيميائية والبيولوجية والإشعاعية والنووية.
كما هو موضح في قانون الصحة بجامعة هارفارد,
وفي نهاية المطاف، كانت الحرب على الإرهاب هي التي أدت إلى الترخيص بالاستخدام في حالات الطوارئ. بعد أحداث 11 سبتمبر 2001 وما تلاها من هجمات الجمرة الخبيثة عبر البريد، أصدر الكونجرس قانونًا قانون مشروع الدرع الحيوي لعام 2004.
• سجل يشير إلى أن الكونجرس كان يركز على تهديد الإرهاب البيولوجي على وجه التحديد، وليس على الاستعداد لوباء يحدث بشكل طبيعي.
ونظراً لهذا النوع الضيق من حالات الطوارئ القصوى التي تنطوي على هجوم بأسلحة الدمار الشامل، فمن المفهوم لماذا لا تتطلب "آلية الوصول" في اتفاقية ترخيص المستخدم النهائي الكثير من الرقابة التنظيمية أو الالتزام بأي معايير تصنيع أو تجارب سريرية.
إذًا ما الذي تتطلبه آلية الوصول إلى اتفاقية ترخيص المستخدم النهائي بالفعل؟
الخطوات الثلاث لترخيص الاستخدام في حالات الطوارئ (EUA)
يجب أن تحدث ثلاثة أشياء حتى يتم منح ترخيص الاستخدام النهائي لمنتج طبي:
- يحتاج وزير الأمن الداخلي أو وزير الدفاع أو وزير الصحة والخدمات الإنسانية إلى تحديد ما إذا كانت هناك حالة طوارئ تنطوي على هجوم أو تهديد بهجوم باستخدام عامل CBRN أو مرض يسببه مثل هذا العامل.
- تحتاج إدارة الغذاء والدواء الأمريكية إلى التأكد من استيفائها لأربعة "معايير قانونية" عند إصدار اتفاقية ترخيص المستخدم النهائي.
- يتعين على إدارة الغذاء والدواء "فرض بعض الشروط المطلوبة" في اتفاقية ترخيص المستخدم النهائي.
EUA الخطوة 1: إعلان حالة طوارئ CBRN
يعد إعلان الطوارئ الخاص بـ EUA منفصلاً وغير مرتبط بأي إعلانات طوارئ أخرى قد يصدرها الرئيس أو سكرتير HHS أو أي شخص آخر. يجب أن يتم إصداره خصيصًا لغرض تفعيل ترخيص الاستخدام النهائي (EUA) ويمكن إنهاؤه أو تمديده بشكل مستقل عن أي إعلان طوارئ آخر.
وهنا ما ينص قانون EUA فيما يلي السيناريوهات الأربعة المحتملة لتفعيل "آلية الوصول" الخاصة باتفاقية ترخيص المستخدم النهائي:
- قرار من وزير الأمن الداخلي بوجود حالة طوارئ محلية، أو احتمال كبير لحدوث حالة طوارئ محلية، تنطوي على خطر متزايد للهجوم بعامل أو عوامل بيولوجية أو كيميائية أو إشعاعية أو نووية؛
- قرار من وزير الدفاع بوجود حالة طوارئ عسكرية، أو احتمال كبير لحدوث حالة طوارئ عسكرية، تنطوي على خطر متزايد على متحد المحافظة القوات العسكرية، بما في ذلك الأفراد الذين يعملون تحت سلطة الباب 10 أو الباب 50، للهجوم باستخدام -
- عامل أو عوامل بيولوجية أو كيميائية أو إشعاعية أو نووية؛ أو
- وكيل أو وكلاء قد يتسببون، أو يرتبطون بطريقة أخرى، في خطر وشيك ومهدد للحياة ومحدد لشركة United المحافظة القوات العسكرية؛
- قرار من قبل سكرتير [وزارة الصحة والخدمات الإنسانية] أن هناك حالة طوارئ صحية عامة، أو احتمال كبير لحدوث حالة طوارئ صحية عامة، تؤثر، أو من المحتمل أن تؤثر بشكل كبير، على الأمن القومي أو صحة وأمن الأشخاص متحد المحافظة المواطنين الذين يعيشون في الخارج، والذي ينطوي على عامل أو عوامل بيولوجية أو كيميائية أو إشعاعية أو نووية، أو مرض أو حالة يمكن أن تعزى إلى هذا العامل أو العوامل؛ أو
- تحديد التهديد المادي وفقًا للمادة 319F-2 من قانون خدمة الصحة العامة [42 جامعة جنوب كاليفورنيا 247د-6ب] كافية للتأثير على الأمن القومي أو صحة وأمن متحد المحافظة المواطنين الذين يعيشون في الخارج.
EUA الخطوة 2. تلبية المعايير القانونية
بمجرد أن يعلن أحد الأمناء أن هناك حالة طوارئ تستدعي ترخيص الاستخدام الطارئ، هناك أربعة "معايير قانونية" أخرى يجب الوفاء بها حتى تتمكن إدارة الغذاء والدواء من إصدار ترخيص الاستخدام الطارئ. وإليك كيف تشرح إدارة الغذاء والدواء الأمريكية (FDA) هذه المتطلبات:
- مرض أو حالة خطيرة أو تهدد الحياة
لكي تقوم إدارة الغذاء والدواء الأمريكية بإصدار اتفاقية ترخيص المستخدم النهائي، يجب أن يكون عامل (وكلاء) CBRN المشار إليه في إعلان ترخيص المستخدم النهائي الصادر عن سكرتير HHS قادرًا على التسبب في مرض أو حالة خطيرة أو مهددة للحياة.
- دليل على الفعالية
المنتجات الطبية التي يمكن النظر فيها للحصول على ترخيص الاستخدام النهائي هي تلك التي "قد تكون فعالة" للوقاية من أو تشخيص أو علاج الأمراض أو الحالات الخطيرة أو المهددة للحياة والتي يمكن أن تسببها عوامل CBRN المحددة في إعلان سكرتير HHS الطوارئ أو التهديد بحالات الطوارئ بموجب المادة 564 (ب).
يوفر معيار "قد يكون فعالاً" الخاص باتفاقية ترخيص المستخدم النهائي مستوى أقل من الأدلة من معيار "الفعالية" الذي تستخدمه إدارة الأغذية والعقاقير (FDA) للموافقة على المنتجات. تعتزم إدارة الغذاء والدواء الأمريكية تقييم الفعالية المحتملة لمنتج ترخيص الاستخدام النهائي المحتمل على أساس كل حالة على حدة باستخدام تحليل المخاطر والفوائد، كما هو موضح أدناه.
[تمت إضافة الوجه الغامق]
- تحليل المخاطر والفوائد
يمكن النظر في الحصول على منتج بموجب اتفاقية ترخيص المستخدم النهائي (EUA) إذا قرر المفوض أن الفوائد المعروفة والمحتملة للمنتج، عند استخدامها لتشخيص المرض أو الحالة المحددة أو الوقاية منها أو علاجها، تفوق المخاطر المعروفة والمحتملة للمنتج.
في تحديد ما إذا كانت الفوائد المعروفة والمحتملة للمنتج تفوق المخاطر المعروفة والمحتملة، قامت إدارة الغذاء والدواء الأمريكية (FDA). ينوي النظر في مجمل الأدلة العلمية لاتخاذ قرار شامل بشأن المخاطر والفوائد. مثل هذه الأدلة التي يمكن أن تنشأ من مجموعة متنوعة من المصادر، قد يتضمن (على سبيل المثال لا الحصر): نتائج التجارب السريرية المحلية والأجنبية، وبيانات الفعالية في الجسم الحي من النماذج الحيوانية، والبيانات في المختبر، متاحة للنظر فيها من قبل إدارة الغذاء والدواء. ستقوم إدارة الغذاء والدواء أيضًا بتقييم جودة وكمية الدواء ادلة متاحة، في ضوء الوضع الحالي للمعرفة العلمية.
[تمت إضافة الوجه الغامق]
- لا توجد بدائل
لكي تصدر إدارة الغذاء والدواء ترخيص الاستخدام النهائي (EUA)، يجب ألا يكون هناك بديل مناسب ومعتمد ومتاح للمنتج المرشح لتشخيص المرض أو الحالة أو الوقاية منها أو علاجها. يمكن اعتبار المنتج البديل المحتمل "غير متاح" إذا لم تكن هناك إمدادات كافية من البديل المعتمد لتلبية الاحتياجات الطارئة بشكل كامل.
EUA الخطوة 3. فرض الشروط المطلوبة
بمجرد حصولنا على إعلان الطوارئ الخاص باتفاقية ترخيص المستخدم النهائي، وبمجرد أن تقرر إدارة الغذاء والدواء أن المنتج قد يكون فعالاً وأن أي دليل متاح يظهر أن فوائده تفوق مخاطره، فهناك طبقة أخرى من التنظيم ذي الصلة.
وإليك كيف أ تقرير خدمة أبحاث الكونجرس لعام 2018 بشأن EUA يوضح هذا:
يوجه قانون FFDCA §564 إدارة الأغذية والعقاقير (FDA) بفرض بعض الشروط المطلوبة في اتفاقية ترخيص المستخدم النهائي (EUA) ويسمح بشروط تقديرية إضافية عند الاقتضاء. تختلف الشروط المطلوبة اعتمادًا على ما إذا كانت اتفاقية ترخيص المستخدم النهائي مخصصة لمنتج غير معتمد أو لاستخدام غير معتمد لمنتج معتمد. بالنسبة للمنتج غير المعتمد، يجب أن تكون شروط الاستخدام:
(1) التأكد من أن المتخصصين في الرعاية الصحية الذين يديرون المنتج يتلقون المعلومات المطلوبة؛
(2) التأكد من أن الأفراد الذين يتم تقديم المنتج لهم يتلقون المعلومات المطلوبة؛
(3) توفير المراقبة والإبلاغ عن الأحداث السلبية المرتبطة بالمنتج؛ و
(4) توفير حفظ السجلات وإعداد التقارير من قبل الشركة المصنعة.
وفي الختام
كما هو مذكور في هذه المقالة، تدرك إدارة الغذاء والدواء الأمريكية/مركز السيطرة على الأمراض بوضوح أن عملية منح ترخيص الاستخدام في حالات الطوارئ (EUA) من غير المرجح أن تولد أي معلومات حول فعالية المنتج أو سلامته. عندما ننظر إلى نص القانون الذي يحكم ترخيص الاستخدام النهائي، نرى أن هذا تقييم صحيح بالفعل.
لا يفرض قانون EUA أي معايير قانونية أو تنظيمية قد تحدد ما إذا كان المنتج آمنًا أو فعالًا. المعايير الوحيدة هي ما إذا كانت إدارة الغذاء والدواء تعتقد أن المنتج قد يكون فعالاً وأن فوائده المعروفة تفوق أضراره المعروفة. إذا لم تكن هناك أضرار معروفة أو فوائد معروفة، لأن المنتج لم يمر مطلقًا بعملية الموافقة على الدواء، فيمكن لإدارة الغذاء والدواء الأمريكية استخدام أي معلومات أو معايير تختارها لاتخاذ هذا القرار.
ويترتب على كل هذا أن الشركة التي يكون منتجها مرشحًا لـ EUA قد تحاول إثبات سلامة المنتج و/أو فعاليته من خلال أي وسيلة تختارها. إن وجود مثل هذه المحاولة (سواء كانت تجربة سريرية أو غيرها من آليات جمع البيانات)، وكيفية إجراء تلك المحاولة، كلها أمور متروكة للشركة. لا يوجد أي شيء في قانون EUA ينطبق على كيفية قيام الشركة بتصميم أو إجراء أو تحليل أي دراسات أو آليات أخرى لجمع البيانات تختار متابعتها.
ينطبق هذا على منتجات Covid وهذا يعني:
- لم تكن هناك حاجة إلى بيانات السلامة أو الفعالية من التجارب السريرية حتى تحصل منتجات كوفيد على ترخيص الاستخدام النهائي (EUA).
- تم إجراء أي تجارب سريرية مشار إليها في عملية EUA بدون معايير تنظيمية قابلة للتطبيق قانونًا.
- عندما نكتشف أن هذه المنتجات تفتقر إلى الفعالية أو الأمان، فهذا ليس مفاجئًا. إنها نتيجة محتملة للغاية لهذه العملية.
- لا توجد بيانات من عملية ترخيص الاستخدام النهائي (EUA) يمكن على أساسها اتخاذ قرارات خارج نطاق ترخيص استخدام الاتحاد الأوروبي (EUA) بشأن سلامة المنتج أو فعاليته. لذا فإن أي استخدام للمنتج خارج نطاق الاتحاد الأوروبي سيتطلب الخضوع لعملية الموافقة القانونية للمنتجات الطبية العادية من البداية.
المزيد عن عملية الموافقة على لقاحات كوفيد هنا.
أعيد نشرها من المؤلف Substack
نشرت تحت أ ترخيص Creative Commons Attribution 4.0
لإعادة الطباعة ، يرجى إعادة تعيين الرابط الأساسي إلى الأصل معهد براونستون المقال والمؤلف.









